
Vitesse de contamination de jeunes plants par les champignons responsables des maladies du bois
Thématiques
Le rôle des nombreuses espèces fongiques impliquées dans les maladies du bois de la vigne a fait l’objet de multiples études ces vingt dernières années. Même si les dégâts sont généralement considérés comme le fruit d’une interaction entre sensibilité variétale, facteurs aggravants de stress, conditions climatiques et action des champignons eux-mêmes, l’observation de symptômes dans des parcelles parfois âgées de moins de 10 ans a soulevé des interrogations quant à une possible implication du matériel végétal. Des travaux menés en France et à l’étranger ont étudié la contamination des plants en pépinière, et plus largement, le rôle du matériel végétal dans la dissémination des pathogènes. Il a ainsi été montré à de multiples reprises que de nombreux champignons se propagent tout au long du processus d’élaboration des plants. Présents dès l’entrée de la pépinière sur les boutures greffons et porte-greffes, en quantités très variables mais principalement sur les écorces, on les retrouve également à l’intérieur des tissus ligneux, les porte-greffes semblant à ce niveau plus contaminés que les greffons.
De très nombreuses équipes de recherche ont mené des essais portant à la fois sur les sources d’inoculum en pépinière, les niveaux de contamination et les champignons impliqués, les étapes clefs et les voies de pénétration dans les greffes-boutures, ainsi que sur l’étude de diverses solutions de désinfection des bois et plants et de biocontrôle. Ces différents travaux ont confirmé :
- la propagation de nombreux champignons,
- le rôle majeur des phases de réhydratation et de stratification,
- l’efficacité limitée des moyens de lutte chimiques ou physiques en termes de désinfection
- et, in fine, la contamination effective des jeunes plants à des niveaux divers et imprévisibles.
Cependant, à ce jour aucune étude n’a permis de mettre en relation la présence avérée de ce primo-inoculum et les symptômes ultérieurs observés au champ. De la même façon, les questionnements sur la cinétique de contamination post-plantation par le milieu extérieur n’ont pas ou très peu été abordés. Or, plusieurs résultats préliminaires issus de comparaisons entre mêmes lots greffes-boutures élevés en serre et implantés en pépinière de plein champ laissaient à penser qu’elle pouvait être rapide et importante (IFV Sud-Ouest, non publié).
Au cours des études visant à comparer l’impact éventuel de diverses techniques de pépinière sur les niveaux de contamination, les analyses effectuées sur des plants issus de greffages herbacés ont systématiquement démontré l’absence totale de champignons impliqués dans les maladies du bois, que ce soit à l’intérieur des tissus, ou sur les écorces (Larignon et al, 2013). Cette technique qui ne fait intervenir que des fragments herbacés (greffons et porte-greffes) durant la période végétative, a donc été retenu dans la suite de l'expérimentation pour obtenir un lot de plants exempt de contamination fongique.
Dispositif et conditions initiales
En 2012-2013, à partir du même matériel végétal de départ (Sauvignon blanc B clone 297 sur 110 Richter clone 237, catégorie initial), deux lots de plants ont été produits, l’un en greffage herbacé et l’autre en greffage ligneux.
Le Sauvignon blanc B a été choisi en raison de sa forte sensibilité connue aux maladies du bois, et de sa tendance à exprimer rapidement des symptômes sur vignes jeunes. Le porte-greffe 110 R, conférant une forte vigueur au greffon, était parfaitement adapté aux objectifs de l’essai, la vigueur en excès étant considérée comme un facteur pouvant favoriser la survenue des symptômes. Une parcelle, au sol vierge de vigne depuis plus de 20 ans, a été implantée sur le site du Domaine Expérimental Viticole Tarnais (vignoble de Gaillac). Elle met en comparaison les deux modalités dans un dispositif en bandes alternées.
Le statut sanitaire des deux lots de plants a été préalablement déterminé par analyses microbiologiques selon la méthode de Larignon et Dubos (1997). Un échantillon de 30 plants issus de chaque lot a été débité à 6 niveaux et des prélèvements de tissus internes ont été mis en culture. En même temps, des prélèvements d’écorces ont été pratiqués sur 5 niveaux, et analysés de la même façon. Les résultats ont permis de constater les fortes différences entre les deux lots :
- Sur les plants issus de greffes-boutures herbacées (GBH) : seul un plant a été trouvé porteur de l’agent du pied noir (Ilyonectria liriodendri) au niveau d’un talon. Ce champignon, largement répandu dans les sols, a probablement été apporté dans ce cas par le substrat de culture. Aucun autre champignon n’a été trouvé, ni sur écorces ni à l’intérieur des tissus, ce qui confirmait les résultats précédemment obtenus.
- Par contre, le lot témoin s’est révélé largement contaminé par plusieurs espèces fongiques. Plus de 76 % des plants étaient porteurs de Botryosphæriaceæ à au moins un des niveaux de prélèvements, dont 60% (18 plants sur 30) hébergeaient au moins une des espèces à l’intérieur des tissus. Sur 43 % des plants, les prélèvements ont permis de trouver les mêmes espèces de Botryosphæriaceæ à la fois sur écorces et à l’intérieur du bois. La présence de ces champignons en pépinière est habituelle et ne constitue pas une surprise, même si le niveau de contamination est élevé dans ce cas.
Méthodologie d’échantillonnage
Dès la campagne suivant la plantation (2014-2015), des prélèvements de troncs ont été effectués sur les deux types de matériel, et un programme d’échantillonnage a été déterminé, mettant en œuvre des recépages et des analyses microbiologiques annuelles.
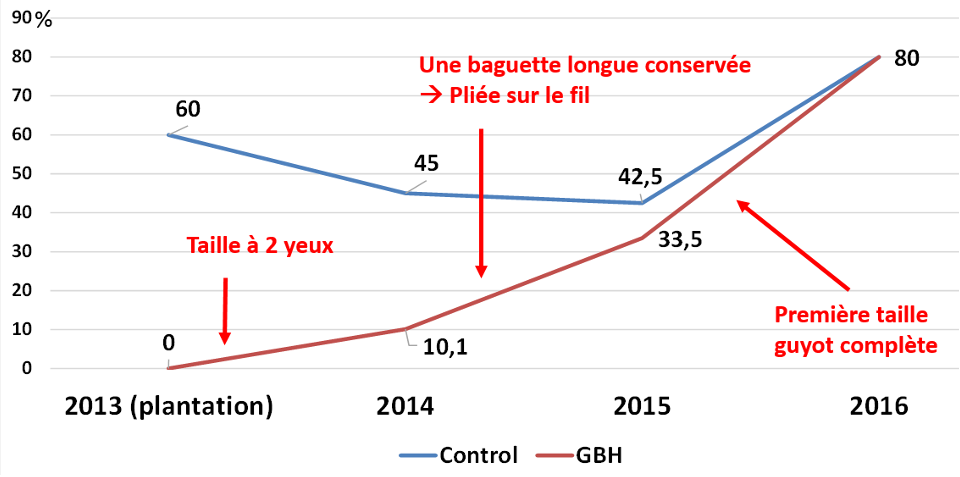
- En fin d’année de plantation, une taille à deux yeux a été pratiquée, aucune analyse n’a été faite
- En année n+1 (2014), la bonne vigueur de la plantation, sur laquelle aucun manquant n’a été à déplorer, a permis de monter convenablement deux troncs sur toutes les souches. Lors de la taille suivante, l’un des deux a été conservé et plié directement sur le fil porteur, et le deuxième a été prélevé pour analyse. Toutes les souches ont été taillées le même jour, afin qu’aucun biais ne compromette l’homogénéité de la parcelle. Sur ces bois, âgés d’un an et dont la croissance a été rapide, les isolements ont été effectués à trois niveaux internes (et à deux niveaux sur les écorces).

Les deux années suivantes (2015 et 2016), des recépages ont été planifiés sur un échantillonnage de 100 souches définies à l’avance. Durant la période végétative, un pampre a été conservé, tuteuré et protégé sur chaque pied. Lors de la taille, le tronc a été prélevé, le recépage permettant de pratiquer les analyses (destructives) sans altérer l’effectif de la parcelle, ce qui aurait pu provoquer des hétérogénéités non souhaitables.
Chaque souche prélevée est ensuite sortie du champ de l’étude une fois analysée, la plaie de recépage (protégée par un mastic) et le rajeunissement du tronc induisant un biais important par rapport aux autres pieds suivant une évolution normale.
Chaque tronc a été emballé individuellement dès son prélèvement, afin d’éviter les contaminations post-taille ou par contact entre les échantillons. La taille pratiquée sur la parcelle, une fois la formation des souches achevée, est un guyot simple avec une baguette à 8 yeux et un courson de rappel à 2 yeux.
Une cartographie précise des souches prélevées, et de leur statut sanitaire révélé par les analyses est réalisée et incrémentée chaque année de l’étude, afin d’observer un éventuel zonage ou une progression préférentielle des contaminations.

Recépage d’une souche fin 2015, et prélèvement du tronc de 2 ans
Résultats : colonisation des plants et apparition des premiers symptômes sur feuilles
Dès l’année qui suit la plantation, les premières mesures montrent une colonisation des plants par les pathogènes, notamment des espèces de Botryosphaeriaceae, résultant finalement en une convergence rapide des statuts sanitaires des deux lots étudiés. La présence des champignons est constatée en surface (écorces) et à l’intérieur des tissus ligneux.
- Au premier échantillonnage (n+1), alors que les ceps n’ont subi qu’une taille à deux yeux, 10.1 % d’entre eux ont été trouvés porteurs de Botryosphaeriaceae à l’intérieur du bois. Ces mêmes champignons sont aussi mis en évidence à l’intérieur de 45 % des plants témoins réalisés en greffe ligneuse, alors que la proportion mesurée avant plantation était plus élevée (60%). Cette différence, révélatrice d’une sous-estimation globale de la présence des pathogènes, peut s’expliquer par la méthode d’échantillonnage (nombre de prélèvements proportionnellement plus important sur des greffés-soudés, associé à une « dilution » probable de l’inoculum de départ durant la forte croissance de première année).
- L’année n+2 (2015), les troncs conservés n’ont connu que de faibles plaies de taille (baguette directement pliée sur le fil porteur), mais le pourcentage de plants où sont retrouvés des champignons (toujours différentes espèces de Botryosphaeriaceae) à au moins un niveau monte à 33.5 %, alors qu’il reste stable dans les témoins (42.5 %).
- L’année n+3, après une première grosse plaie liée à la taille guyot, le taux monte brusquement à 80 % pour les deux modalités comparées (respectivement 34 plants sur 40 analysés pour les témoins, et 46 sur 60 plants pour les GBH)
- L'année n+4 (2017), permet de constater l'apparition de symptômes foliaires sur un plan issu du lot en GBH. La survenue de ce premier symptôme est très précoce, la vigne n’étant âgée que de 4 ans et le pied présumé exempt de champignons à la plantation.

- Fin 2019, ce sont désormais 8 pieds qui présentent des symptômes foliaires : 2 provenant du lot témoin et 6 du lot en GBH
De nombreuses questions restent posées suite à ces résultats, concernant l’origine de l’inoculum (même si les éléments exposés plaident pour un rôle déterminant du milieu extérieur), les voies privilégiées de pénétration, l’action effective des champignons dans les tissus et leur lien avec d’éventuels symptômes ultérieurs, etc.
Enfin, ces résultats posent la question de l’efficacité en termes de prophylaxie d’une désinfection poussée en pépinière, considérant le caractère massif et rapide des contaminations à la parcelle par différentes espèces de Botryosphæriaceæ. Le lien entre ces champignons et les symptômes observés n’étant cependant pas établi, et P. minimum et P chlamydospora, deux espèces pionnières de l’esca, n’ayant pas été retrouvées dans ce travail, beaucoup reste à faire avant de pouvoir tirer des conclusions définitives sur le sujet. De futurs travaux sur cette parcelle et sur d’autres permettront peut-être de mieux préciser l’ensemble des processus à l’œuvre.
De nouveaux essais menés dans le cadre du programme Origine
La mise en place de la parcelle et les premières années de suivi ont été financées par FranceAgriMer, et la poursuite de ces travaux de longue haleine fait partie du projet Origine, (plus particulièrement de l'action visant à étudier les facteurs de dépérissement sur jeunes plants). Les contaminations par les champignons s’étant avérées très rapides, et les résultats concernant leur cinétique ayant été acquis dès le début du projet, il a été jugé pertinent d’implanter un second dispositif suivant un plan d’expérience légèrement différent (disposition des blocs). En plus de la réalisation des mêmes suivis de contamination, la nouvelle étude a pour but de déterminer l’origine de l’inoculum qui envahit rapidement les plants issus de greffages herbacés, originellement exempts, grâce notamment à une caractérisation moléculaires des champignons pathogènes présents dans les plants témoins. L’objectif est de tenter de quantifier la part de responsabilité dans ces contaminations entre l’environnement (vignes déjà présentes, autres végétaux aux alentours, …) et l’inoculum introduit avec les plants eux-mêmes (témoins porteurs de champignons sur les écorces ou dans les tissus internes).
Cette parcelle a été implantée au printemps 2020, et les analyses moléculaires sont en cours de réalisation au pôle Val de Loire de l’IFV. Aucun champignon pathogène n’a préalablement été trouvé dans les greffes-boutures herbacées, ce qui confirme la validité de ce modèle pour ce genre d’études.
Bibliographie :
- Billones-Baaijens R., Allard A., Hong Y., Jones E.E., Ridgway H., Jaspers M.V., 2014. Management of Botryosphaeria species infection in grapevine propagation materials. Phytopathologia Mediterranea 53, 589.
- Dubos B., 1999. Maladies cryptogamiques de la vigne. Editions Féret, 174 p.
- Fourie P.H., Halleen F., 2006. Chemical and biological protection of grapevine propagation material from trunk disease pathogens. European Journal of Plant Pathology 116, 255–265.
- Gramaje D., Armengol J., 2011. Fungal trunk pathogens in the grapevine propagation process: potential inoculum sources, detection, identification, and management strategies. Plant Disease 95, 1040–1055.
- Gramaje D., Di Marco S., 2015. Identifying practices likely to have impacts on grapevine trunk disease infections: a European nursery survey. Phytopathologia Mediterranea, 54, n. 2, p. 313-324.
- Halleen F., Crous P.W., Petrini O., 2003. Fungi associated with healthy grapevine cuttings in nurseries, with special reference to pathogens involved in the decline of young vines. Australasian Plant Pathology 32, 47–52.
- Hunter J.J., Volschenk C.G., Le Roux D.J., Fouché G.W., Adams L., 2004. Plant Material Quality, a compilation of research. Research Reports, ARC Infruitec-Nietvoorbij, Stellenbosch, South Africa.
- Larignon, P. (2012). Maladies cryptogamiques du bois de la vigne: symptomatologie et agents pathogènes. http://www.vignevin.com
- Larignon P., Dubos B., 1997. Fungi associated with esca disease in grapevine. European Journal of Plant Pathology, 103: 147-157.
- Larignon P., Baptiste C., Mallet J.F., Granier J.P., Bloy P., 2013. Greffage en vert, premier test contre les maladies du bois: Essai préliminaire sur l'intérêt de cette technique pour produire des plants de vigne indemnes des champignons associés à ces maladies. Phytoma 661, pp. 33-35.
- Larignon P., Bérud F., Girardon K., Dubos B., 2006. Maladies du bois de la vigne. Et les pépinières ? Quelques éléments sur la présence des champignons associés, leur localisation dans le bois et les moments de contamination. Phytoma. 592, 14-17.
- Larignon P., Dubos B., 2001. Le Black Dead Arm. Maladie nouvelle à ne pas confondre avec l’esca. Phytoma, 538, 26-29.
- Larignon P., Coarer M., Girardon K., Bérud F., Jacquet O., 2009. Propagation of pioneer fungi associated with esca disease by vegetative material in French grapevine nurseries. Phytopathologia Mediterranea 48, 177.
- Mercier pépinières, 2017. Greffe herbacée. http://www.mercier-groupe.com/fr/produits/greffe-herbacee
- Retief E., Damm U., Mc Leoda, Fourie P.H., 2005. Petri disease : potential inoculum sources in South African grapevine nurseries. 4th International Workshop on grapevine Trunk Diseases, Stellenbosch.
- Spagnolo A., Larignon P., Magnin-Robert M., Hovasse A., Cilindre C., Van Dorsselaer A., Clément C., Schaeffer-Reiss C., Fontaine F., 2014. Flowering as the most highly sensitive period of grapevine (Vitis vinifera L. cv. Mourvèdre) to the Botryosphaeria dieback agents Neofusicoccum parvum and Diplodia seriata infection. International Journal of Molecular Sciences, 15, 9644–9669.
- Stamp J. A., 2001: The contribution of imperfections in nursery stock to the decline of young vines in California. Phytopathologia Mediterranea, 40 (supplement), 369-375
- Viguès V., Dias F., Barthélémy B., Yobrégat O., Coarer M., Larignon P., 2008. Maladies du bois de la vigne, des étapes à risque identifiées en pépinière. Phytoma, 621, 30-32.
- Viguès V., Yobrégat O., Barthélémy B., Dias F., Coarer M., Larignon P., 2009. Fungi associated with wood decay diseases : identification of the steps involving risk in a French nursery. Phytopathologia Mediterranea, 48, 177.
- Viguès V., Yobrégat O., Barthélémy B., Dias F., Coarer M., Girardon K., Bérud F., Muller M., Larignon P, 2010. Wood decay diseases: tests of disinfection methods in French nursery. Phytopathologia Mediterranea, 49, 130.
- Waite H., Morton L., 2007. Hot water treatment, trunk diseases and other critical factors in the production of high-quality grapevine planting material. Phytopathologia Mediterranea 46 (1): 5-17.
- Waite H., Whitelaw-Weckert M., Torley P., 2015. Grapevine propagation: principles and methods for the production of high-quality grapevine planting material. New Zealand Journal of Crop and Horticultural Science, 43:2, 144-161.
- Whiteman S.A., Stewart A., Ridgway H.J., Jaspers M.V., 2007. Infection of rootstock mother-vines by Phaeomoniella chlamydospora results in infected young grapevines. Australasian Plant Pathology 36, 198–203.
- Yobrégat O., Larignon P., 2014. Maladies du bois : les greffes-boutures herbacées, matériel d’étude précieux pour évaluer les contaminations au vignoble. La Grappe d’Autan, n°100
